Publications研究業績
生体分子モーターの予想外の動きを観る
(現代化学2021年7月号原稿)
生命とは、分子マシンシステム
タンパク質や核酸でできた生体分子マシンは、生命の活動を支えています。生体分子マシンの多くは、一方向に運動する分子モーターとしての機能を持っています。生体分子モーターの代表例は筋肉のミオシンや細胞内で小胞を運ぶキネシンですが、他にも沢山あります。例えば生命においては、遺伝情報はDNAやRNAといった鎖状の高分子にコードされています。この遺伝情報を読み書きするには、DNA合成酵素、RNA合成酵素、リボソームといった生体分子マシンはDNAやRNAの鎖に沿って一方向に動く必要があります。つまり、DNA→RNA→タンパク質という生命のセントラルドグマに関わる分子マシンの多くは分子モーターなのです。よって、一方向に速く正確に動くというのは、生命にとって必要不可欠な機能であると言えます。生命とは、分子モーターをはじめとする分子マシンが高度に集積化された分子マシンシステムであると私は考えています。
私のラボでは、1分子イメージングの技術を開発し、生体分子モーターの動きを「観る」ことで仕組みを理解する研究を推進しています(もう一つの柱として「創る」ことで仕組みを理解する研究も進めていますが、本稿では字数の関係で割愛します)。話は少し脱線しますが、ニューヨークヤンキースで捕手や監督を務めたYogi Berra氏は独特の言いまわしの語録で有名です。彼の語録の一つに“You can observe a lot by watching.”があり、書籍のタイトルにもなっています。Berra氏の語録にならい私たちは、「観るだけでいろいろわかる」をモットーに研究を進めています。
1分子イメージングで分子モーターの動きを観ていると稀に、予想外の動きに出会うことがあります。そして予想外の動きが観えた時は、より大きな発見に繋がります。まさにセレンディピティであり、研究の醍醐味です。ここでは、私たちが経験したいくつかのセレンディピティについて、昔話と裏話を中心にご紹介したいと思います。
ATP合成酵素の回転の秘密
ATP合成酵素は、細胞膜を介する水素イオンの電気化学ポテンシャルを用い、高エネルギー化合物であるATPを合成します(図1a)。ATP合成酵素は、細胞膜に埋め込まれ水素イオンを輸送するFoモーター(図1b)と、ATPを合成・分解するF1モーター(図1c)の2つの回転分子モーターの複合体であり、内部の回転子サブユニットの回転運動を介して電気化学ポテンシャルと化学エネルギーを高効率かつ可逆的に変換します。尚、「生命とは、分子マシンシステム」といきなり矛盾するようで申し訳ないのですが、ATPを合成するために何故、自然が回転という運動様式を採用したのかは明らかではありません。高いエネルギー変換効率や可逆性と関係がありそうなのですが、進化の過程で偶然に生まれた可能性もあります。
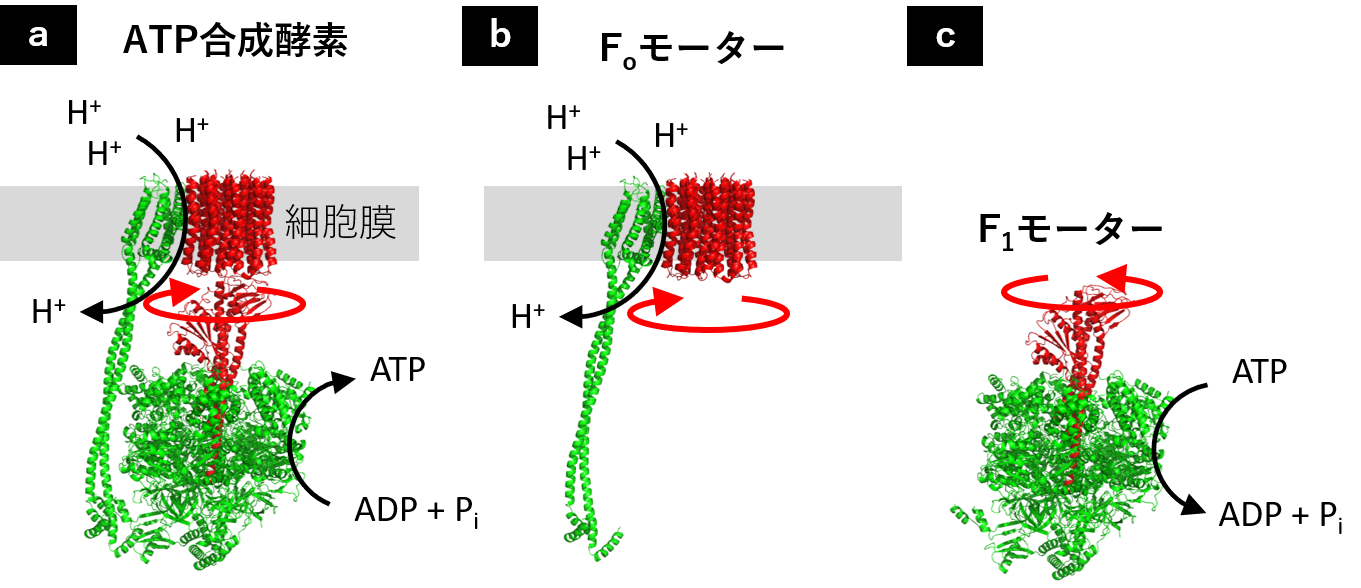
図1.a) 好熱菌由来ATP合成酵素の全体構造(PDB ID:6N2Y)。b) Foモーター。c) F1モーター。赤色が回転子、緑色が固定子に対応する。
ATP合成酵素からF1モーターだけを単離するとATP合成はせず、ATPを分解しながら一方向に回転します(図1c)。F1モーターは固定子のα3β3リングと、棒状の回転子サブユニットγからできています。βは触媒サブユニットで(図2)、三つのβが順番を守って協調的にATP分解と構造変化を行うことで、γを一方向に回転させます。しかしながら、三つのβの間にはαがあり、お互いに接触(相互作用)していないので、協調性がいかに達成されるのかが謎でした。他方、回転子のγは全てのβと相互作用しているため、γが独裁者の様に振る舞い、3つのβの化学状態と構造状態をコントロールすることで一方向に回転するという「γ独裁者モデル」が提唱され、多くの支持を得ていました。私たちは、意外な形でγ独裁者モデルを検証し、全く異なる新しいモデルを提唱することができました(文献1)。
私は当時、野地博行先生(当時阪大、現東大)のラボに所属しており、内橋貴之先生(当時金沢大、現名大)、安藤敏夫先生(金沢大)と共同で、高速原子間力顕微鏡1分子イメージングによるATP合成酵素の回転観察に取り組んでいました。電気化学ポテンシャル駆動の回転運動を直接可視化する試みで、うまくいっていませんでした。そこで内橋先生と相談し、より取り組みやすい、F1モーターからγを引き抜くのに必要な力を測定し相互作用の強さを見積もる、というテーマを並行して進めることにしました。こちらはうまくいったのですが、γが本当に抜けたか確認するためのコントロール実験として、はじめからγのないα3β3リングを観察してみることにしました。すると確かに、3回対称性を持ち中央に穴の開いたリングが観えました(図2a)。この時、「γ独裁者モデル」が頭をよぎった私は、試しにATPを入れてみましょうと提案しました。その結果、予想外に、リングが非対称な形に変化し(図2b)、3つのβが反時計回りに順番に構造を変える様子が観察されました(図2c)。つまり、γなしのF1が「回った」のです。すぐにボスの野地先生に動画をみせたのですが、彼の最初の反応は残念ながら「回ってる?うーん、わからない。」でした。その後、両ボス(野地先生、安藤先生)に納得して頂くため、内橋先生と様々な実験や解析を追加して論文を作成し、投稿に至りました(文献1)。幸い査読者3名ともポジティブで、1名からは“This excellent manuscript can be published as it stands.”と最上のコメントを頂きました。後にも先にも、こんな嬉しいコメントを貰ったのはこの時だけです。
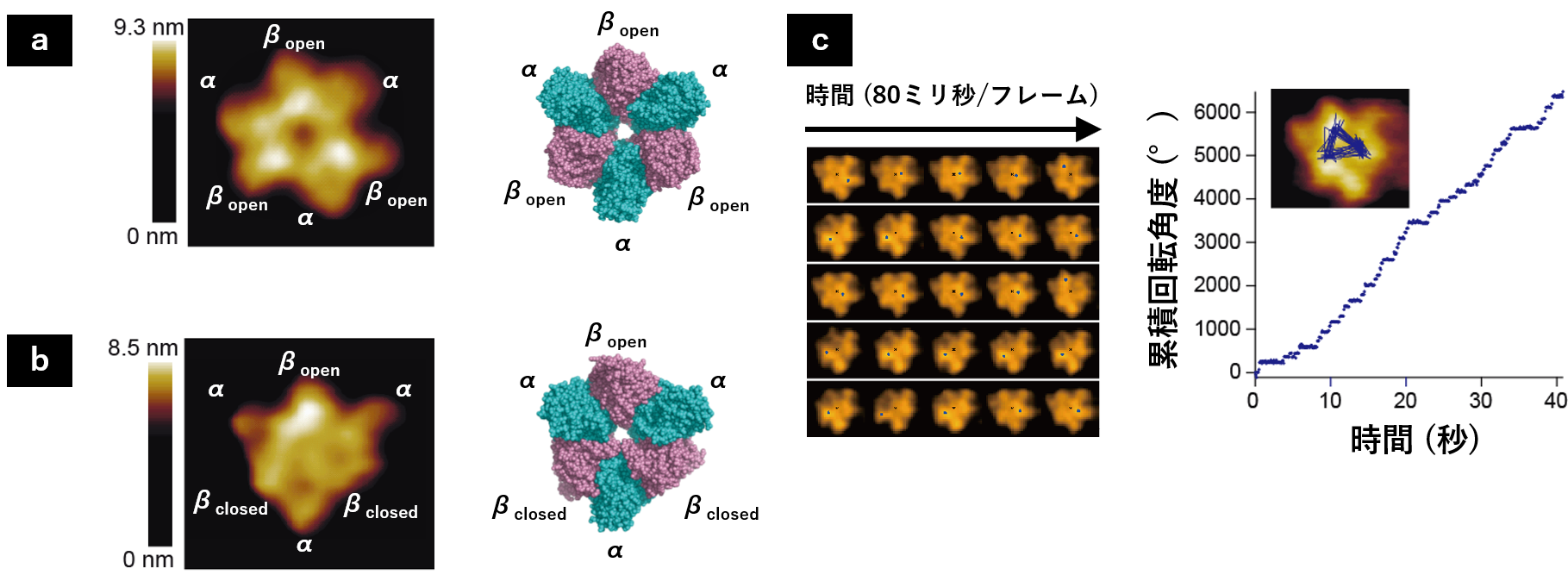
図2.a) ATPなしの固定子α3β3リングの高速AFM像(左)と結晶構造(右)。βをピンク色、αを水色で示す。b) AMPPNP(分解できないATP類似化合物)存在下での固定子α3β3リングの高速AFM像(左)と結晶構造(右)。c) ATP存在下での高速AFM像のシークエンス(左)とβの構造変化の回転のタイムコース(右)。開いた背の高いβopenを青い点で示す。
上記の結果は、F1モーターの一方向回転を支える協調性の基盤は固定子α3β3リングに刻まれており、回転子γは必須でないことを示しています。他方、γがない場合、回転の速度が1/10程度に低下し、さらに10回に1回程度、逆方向に回る(但し1回のみで連続的に逆方向に回ることはない)ことも明らかとなりました。よって、γは必須ではないが速く正確に一方向に回るにはあった方が良い、となります。私たちはこれを「民主制モデル」と名づけました。尚、生体1分子イメージングの先駆者である木下一彦先生(当時早稲田大、故人)は、私たちの成果を「γプロフェッサーモデル」と名づけて下さいました。その心は、「教授がいなくてもラボは回るが、いた方がよく回る」とのことでした。このモデルの是非の判断は読者の皆様に委ねます。
さらに上記の結果は、回転子γに大きさや形が似ている物体を固定子α3β3リングに挿入すれば、一方向に回転する可能性を示唆しています。実際、この後の研究で、γに形が似ているがアミノ酸配列や表面の性質(電荷や疎水性)が大きく異なる別のタンパク質をα3β3リングに挿入すると一方向に回転することが示されました(文献2、創るアプローチに相当)。これは、一方向性の回転運動を達成するには、生体分子でよく言われる「鍵と鍵穴」のような精緻な相互作用は必須でないことを意味します。極論を言えば生体分子である必要はなく、人工分子でも形や大きさをγに似せることができれば、一方向に回る可能性があります。将来は、生体・人工ハイブリッド回転分子モーターが創れると良いなと思っています。このハイブリッドモーターを光駆動人工回転分子モーター(文献3)でムリヤリ逆に回すことができれば、光エネルギーでATPを合成できるのではと考えています(人工光合成)。
回転しながら直進するキネシン
キネシンはATPのエネルギーを使って微小管上を直進するリニア分子モーターで、細胞内の小胞輸送等を担っています。キネシンには様々な種類があり機能も多様ですが、本稿では最初に発見されたキネシン-1(以下では簡単のためキネシンと呼びます)に関する私たちの予想外の発見を紹介します(文献4)。キネシンは二本の足を持ち、いわゆるhand-over-handモデルで歩きます(図3a)。このモデルでは、後足が微小管から解離して前足を追い越して前方に着地する、というサイクルを繰り返します。ここでも、二本の足がいかに協調してATP分解と構造変化を行うのかが、速く正確な歩行を達成する上で重要になります。また、二本足で歩くキネシンには、片足が微小管から離れた非結合状態が存在します(図3b)。ナノサイズの世界では人間の歩行とは異なり慣性に頼ることはできず、激しい熱ゆらぎに曝されるため、浮いた足がどのように振舞うのかを理解することが歩行の仕組みを理解する上で重要になります。
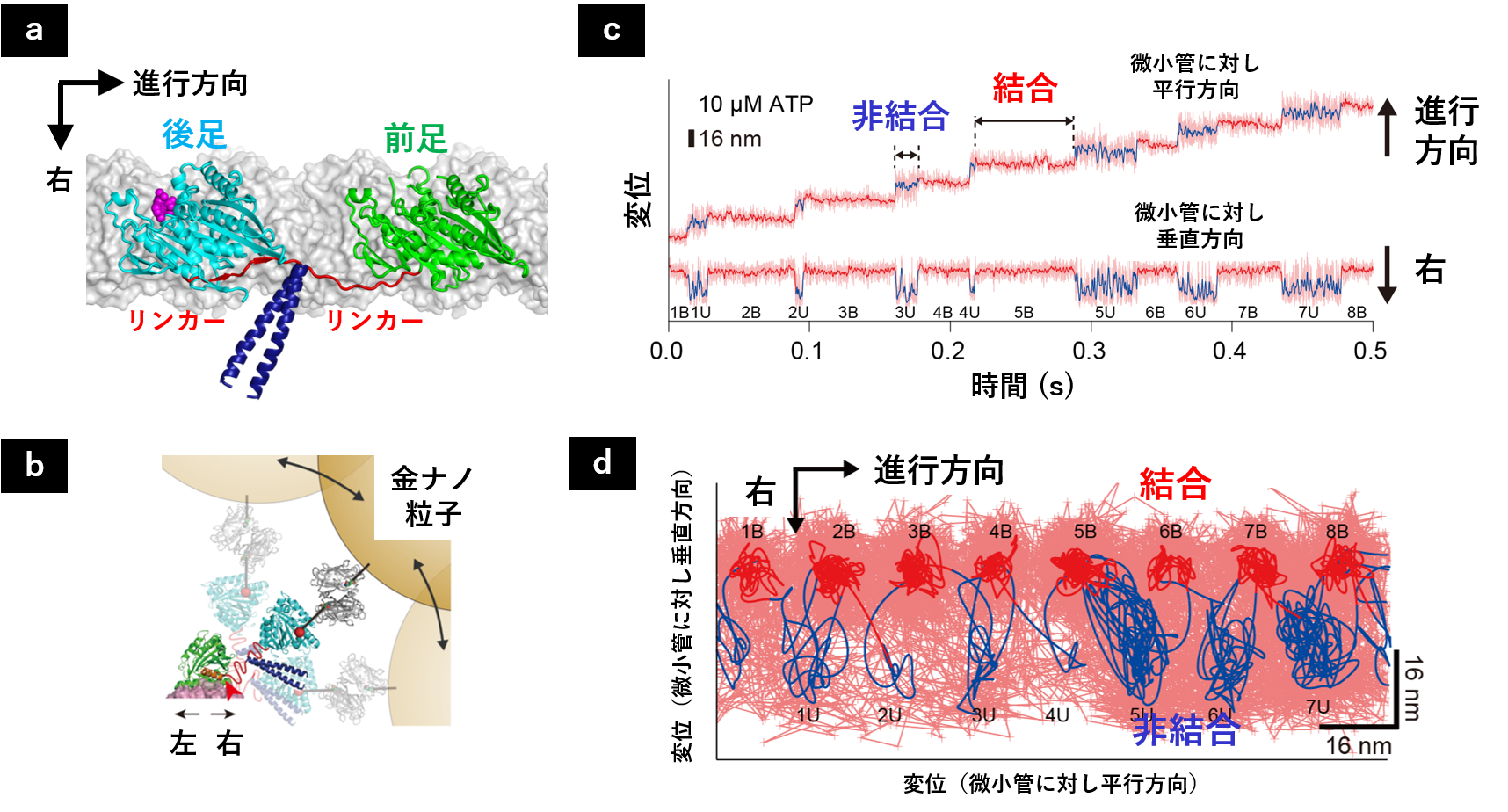
図3.a) 上から見たキネシンの構造モデル(両足結合状態)。b) 後ろからみたキネシンの構造モデル(片足結合状態)。c) キネシンの片足の動きのタイムコース。d) キネシンの片足の動きの二次元プロット。時間分解能は55マイクロ秒。
私たちは、独自に開発した光学顕微鏡による高速高精度1分子イメージングでこの課題に取り組みました。私たちの手法では、分子モーターに目印となる金属ナノ粒子を結合させ、散乱イメージングを行うことで粒子の動きとして分子の動きを追跡します。蛍光イメージングよりも圧倒的に高いシグナルが得られるため、マイクロ秒の時間分解能とオングストローム(原子サイズレベル)の位置決定精度(どれだけ正確に動きを追跡できるかの指標)を達成することができます(図4)(文献5)。さらに、銀、金、銀金合金ナノ粒子を併用することで、マルチカラー高速高精度1分子イメージングも可能となります(図5)(文献6)。
キネシンの片足に粒径40 nmの金ナノ粒子を結合させ、歩行中のキネシンの足の動きを追跡した結果、微小管から離れた足がブラウン運動を行う様子を観察できました(図3c, d)。この結果は、キネシンは構造変化だけでなくブラウン運動も利用して歩行することを強く示唆します。他方、予想外に、浮いた足のブラウン運動は前後左右に等方的ではなく、進行方向に対して右側に偏っていました(図3c, d)。何故偏っているのだろう?と初めは疑問でしたが、微小管に結合したキネシンの構造モデルを考慮すると理解できました(図3a, b)。すなわち、両足を繋ぐリンカー(図3a, bの赤色部分)が微小管に結合した足の右側に位置するため、立体障害でブラウン運動が右側に制限されるのだと解釈することができました。

図4.金ナノ粒子の位置決定精度の計測。a) ガラス基板に固定した粒径40 nmの金ナノ粒子の散乱像(左)を取得し、重心位置の分布(中央)を求め、分布の標準偏差σ(右)を位置決定精度とする。b) 1フレームの画像で得られた光子数Nと位置決定精度σの関係。100万個の光子でオングストロームの位置決定精度が達成可能となる。
さらに重要なことは、後ろ足が微小管から解離して右側で揺らぎ前足を追い越して前方に着地するというサイクル繰り返す場合、キネシンは直進運動の際に一方向に回転すると予想されることでした。つまり、キネシンはリニア分子モーターであると同時に回転分子モーターであると考えられたのです。このアイデアを共同研究者の富重道雄先生(当時東大、現青山学院大)と議論したのですが、実験的証拠が十分でないことから、最終的に論文には記述しませんでした(文献4)。しかしながらその後、回転モデルを実証する方法を思案している間に、別の1分子イメージングの手法でキネシンの回転運動を観察した論文がドイツのグループから出版されてしまいました(文献7)。同グループは今年に入り、さらに発展させた回転モデルを発表しています(文献8)。証拠は少なくとも面白い仮説に賭け、先に提案しておけばよかったと忸怩たる思いです。
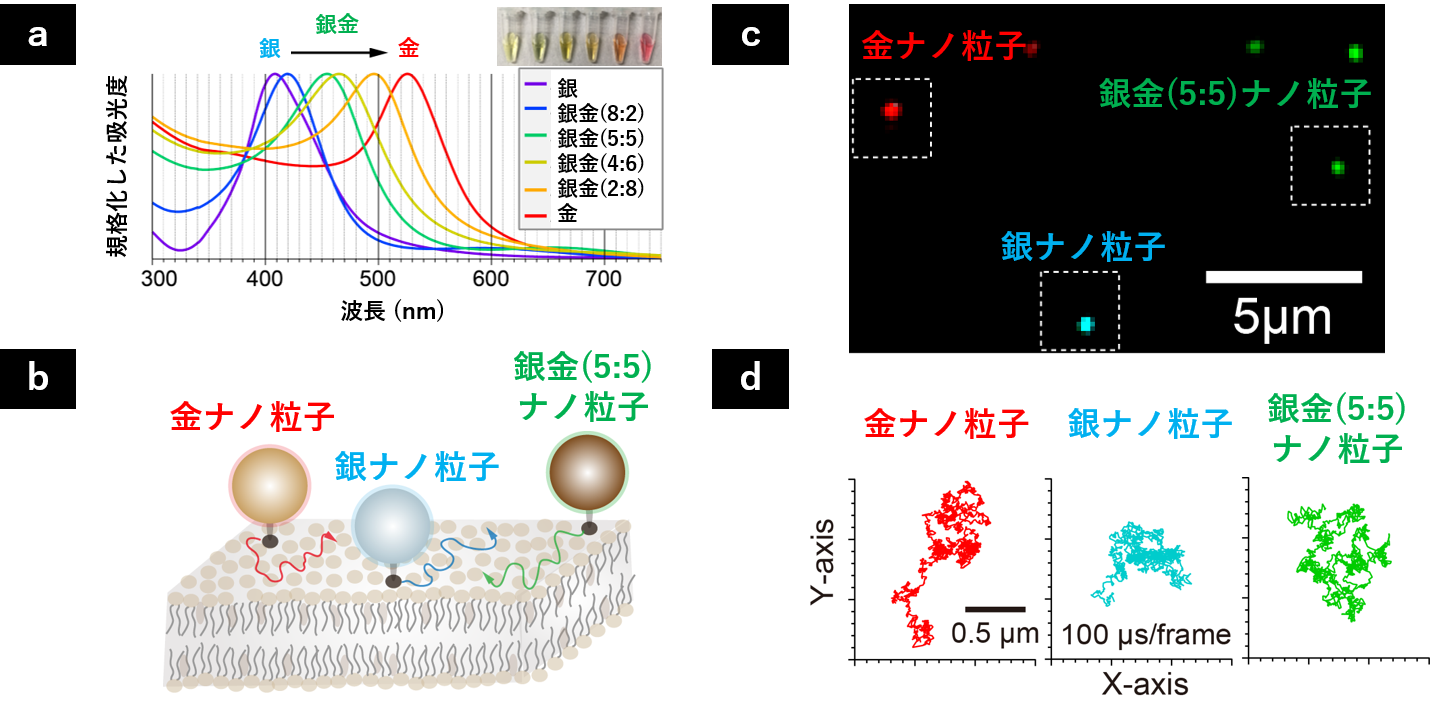
図5.基板支持脂質二重膜中の脂質分子の拡散運動のマルチカラーイメージング。a) 銀、金、銀金合金ナノ粒子の消光スペクトル。合金は混合比でプラズモン共鳴のピーク波長が変化。b)実験系の模式図。c) 観察像の例。d) 拡散運動の軌跡。時間分解能は100マイクロ秒。
いろいろな分子モーターのこれから
本稿では、1分子イメージングによる予想外の発見に焦点を当てました。私たちは、回転分子モーターV-ATPase、リニア分子モーターダイニン、新しいリニア分子モーターキチナーゼ(文献9)などほかの分子モーターについても研究を進めていますが、紹介する前に誌面が尽きてしまいました。1分子イメージングによる生体分子モーターの研究は既に4半世紀以上の歴史がありますが、仕組みを完全に理解するためにやるべきことはまだまだたくさんあると思っています。何より、分子1個が動く姿を直接目の当たりにするのは楽しく、何度観ても飽きません。また、生体分子モーターを創って仕組みを理解する試みは始まったばかりであり、今後大きく発展すると期待しています。さらに最近は、生物に学び、物理で理解し、化学で人工分子モーターを創る、という分野を超えた取り組みも盛り上がっています(文献10)。若いフレッシュな皆様の参入をお待ちしています。
参考文献
1. T. Uchihashiほか, Science, 333, 755 (2011)
2. M. Babaほか, Proc. Natl. Acad. Sci. U S A, 113, 11214 (2016)
3. D. Rokeほか, Proc. Natl. Acad. Sci. U S A, 115, 9423 (2018)
4. H. Isojimaほか, Nat. Chem. Biol., 12, 290 (2016)
5. J. Andoほか, Biophys. J., 115, 2413 (2018)
6. J. Andoほか, ACS Photonics, 6, 2870 (2019)
7. A. Ramaiyaほか, Proc. Natl. Acad. Sci. U S A, 114, 10894 (2017)
8. S. Sudhakarほか, Science, 371, eabd9944 (2021)
9. A. Nakamuraほか, Nat. Commun., 9, 3814 (2018)
10. R. Iinoほか, Chem. Rev., 120, 1-4 (2020)
