
Research
Rhythm & hierarchy, structure, and diversity of biological clock systems
Mystery #1: Circadian Rhythm & Hierarchy
私たちの身のまわりに散見するリズム──昆虫の飛翔、メトロノーム、脈拍、潮汐、地球の自転…、そして命を次世代に受け継ぐという意味では生物の生死もまたリズム現象に位置付けられます。体内時計は生体リズムの一つに分類されますが、私たちがその存在に気づかされるのは帰国後に残る時差ボケの症状からではないでしょうか。これは普段から意識することなく行っている様々な活動が、次のような性質を有する体内時計システムによって制御されていることを示しています。
Numerous rhythms surround us, such as the flight of an insect, the ticking of a metronome, the Earth’s rotation, and various pulsations, ebbs, and flows. The lives and deaths of organisms are also regarded as rhythmic phenomena in that life is passed on to the next generation. Biological clocks are categorized as a biological rhythm; most of us probably notice its existence when suffering from jet lag after traveling across different time zones. Various daily activities that we perform subconsciously are controlled by biological clock systems that have the following characteristics:


私たちの目指す「理解」のかたちとは、体内時計システムを特徴づける3つの性質を統一的に説明することに他なりません。この課題に取り組むうえでの理想的な実験系として、シアノバクテリアの体内時計システムが挙げられます。
We seek to explain these three characteristics, and consider the biological clock system of cyanobacteria to be an ideal experimental model.
「水中の植物」とも称されるシアノバクテリアは、生育に要するエネルギーを光合成で賄っています。太陽光を利用できる時間帯は昼夜環境サイクルによる制限を受けますので、夜間はエネルギーの安定供給が見込めません。これに付随するように、一部のシアノバクテリアは転写や翻訳といった生命活動を夜間に一時休止させてエネルギー消費量を抑えています。翌朝、日の出を認識してから転写・翻訳を再開させると、光合成系の準備が整うまでのあいだに光エネルギーを獲得する機会を一部失うことになります。そこで、転写・翻訳が抑制された夜間に残存するタンパク質で時を計り、日の出のタイミングに合わせて光合成を含めた生命活動を活性化させているわけです。タンパク質からなるシアノバクテリアの生物時計システムは、限りある日照時間の有効利用をつうじて生存により有利な状況を作り出そうとしてきた、35億年にわたる進化の産物であると言えます。
Cyanobacteria, also called “water plants,” photosynthesize to secure the energy needed for growth. The time that sunlight is available is limited due to the day and night cycle, and hence a stable energy supply is not expected at night. Cyanobacteria seemingly cope with this situation by reducing nocturnal energy consumption by suspending vital activities such as transcription and translation. If they were to wait to resume transcription and translation until they detected the sunrise, their opportunity to procure solar energy would be delayed until their photosynthetic system was ready. To alleviate this, they measure time using proteins that still function at night so that they can activate photosynthesis and other vital activities immediately at sunrise. Cyanobacteria’s protein-based biological clock system is the product of over 3.5 billion years of evolution during which they have improved survival conditions despite limited hours of sunlight.
シアノバクテリアが理想的な実験系とされる最大の理由は、「時計の3性質」を満たすコア振動子を試験管内で容易に再構成できることです。KaiA、KaiB、KaiCと呼ばれる3種類の時計タンパク質とATPを混ぜ合わせると、KaiCのかたちや酵素活性が24時間周期でリズミックに変化します。試験管内で扱えるメリットを活かして、生物学はもとより、広く化学や物理学からのアプローチを統合しながら研究を進めたところ、細胞から原子のスケールにまで及ぶ時計システムの描像が明らかとなってきました(Abe et al. Science, 2015)。
The major reason that cyanobacteria are considered to be an ideal experimental model is that the core oscillator that possesses the three characteristics of the clock can be easily reconstructed within a test tube. When mixing the three clock proteins KaiA, KaiB, and KaiC with ATP, the structure and enzyme activity of KaiC change rhythmically during a 24-hour cycle. Taking advantage of this test tube experiment, we used an approach combining biology, chemistry, and physics to elucidate the means by which the clock system extends from the cellular to atomic levels (Abe et al. Science, 2015).
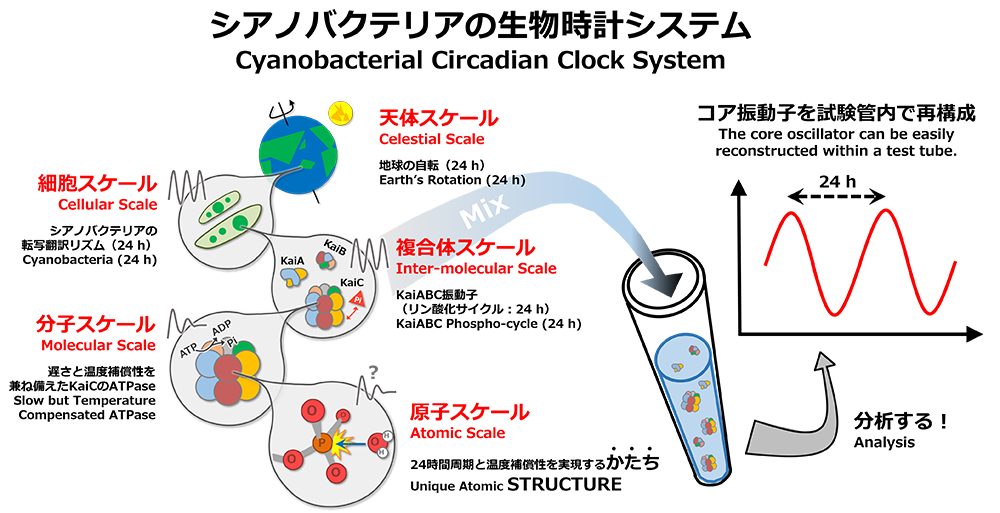
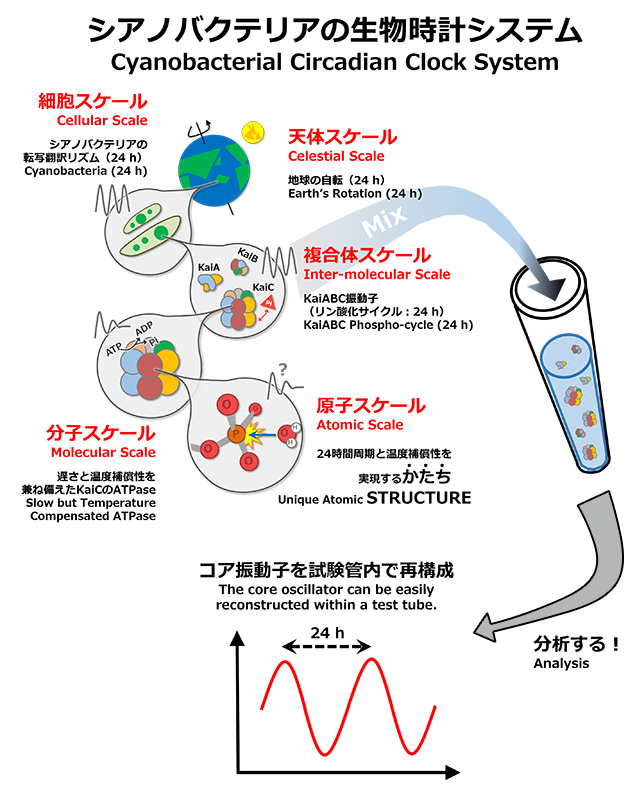
3種類あるKaiタンパク質のうち、KaiCは振動子の中核に位置付けられる重要なタンパク質です。KaiAとKaiBが共存するとKaiCは自己リン酸化/脱リン酸化のリズムを刻みますが(Nakajima et al., Science, 2005)、その周期はKaiC単独(KaiAやKaiBが存在しない状況下)のATPase活性に依存します(Terauchi et al. PNAS, 2007)。例えば、アミノ酸変異によってKaiC単独のATPase活性が2倍に向上すると、in vitro振動子だけでなく細胞内リズムの振動数も2倍になります(周期は1/2)。このような不思議な性質は貫階層性と呼ばれ、in vitroレベル、延いては細胞レベルの周期(周波数)や温度補償性までもが、KaiCの機能やかたちによる影響(支配)を多分に受けます。KaiCにエンコードされた24時間性(1日1回)や温度補償性はどのようにデコードされ、そして細胞レベルのリズムへと伝播されていくのでしょうか?
Among the three Kai proteins, KaiC is the most important, and is located at the core of the oscillator. In conjunction with KaiA and KaiB, KaiC reflects the rhythm of autophosphorylation and dephosphorylation (Nakajima et al., Science, 2005); however, the cycle of this rhythm depends on the ATPase activity of KaiC independent of KaiA or KaiB (Terauchi et al. PNAS, 2007). For example, when the ATPase activity of KaiC doubles as a result of amino acid mutations, the frequencies of both the in vitro oscillator and the intracellular rhythm also double (the cycle period is reduced to half). This mysterious characteristic is called a transmural hierarchy, in which the cycle (frequency) and even the temperature compensation both in vitro and in vivo are greatly affected (controlled) by the function and structure of KaiC. How are the circadian activities and temperature compensation features that are encoded in KaiC decoded and propagated to rhythms at the cellular level?
Mystery #2: Structure
リズム現象を何か一つ想像してみてください。ここでは振り子を例にとりましょう。おもりを手で持ち上げて離すと、振り子は一定の周期で運動を始めます。そのときの周期(T)は次のように定義されます。
Think of a rhythmic phenomenon. Let’s take a pendulum, for example. If you displace its weight sideways and then release it, the pendulum starts its periodic movement. The period is defined as follows:
ここでLは振り子の長さを、gは重力加速度に相当します。この式から24時間周期の振り子を実現するための紐の長さが計算できます(1.85 Gm:太陽の直径よりも長い・・・)。体内時計と同じ周期で振動する巨大な振り子を構築することは理論上可能だとしても、現実的にはほぼ不可能だと言えます。振り子のかたちを維持できる素材を私たちの身の周りに見出すことができないためです。ある現象を説明するときには、かたちと素材の整合性が担保されているかを常に確認する必要があります。
Here, L denotes the length of the pendulum, and g the gravitational acceleration. The length of the string needed to obtain a pendulum with a 24-hour period can be calculated with this formula. (The answer is 1.85 Gm — greater than the diameter of the Sun). Creating a gigantic pendulum that moves with the same period as a biological clock is theoretically conceivable but is almost impossible in reality, as the proper construction materials do not exist. When explaining a certain phenomenon, therefore, it is necessary to constantly check if there is compatibility between the desired structure and the materials available.
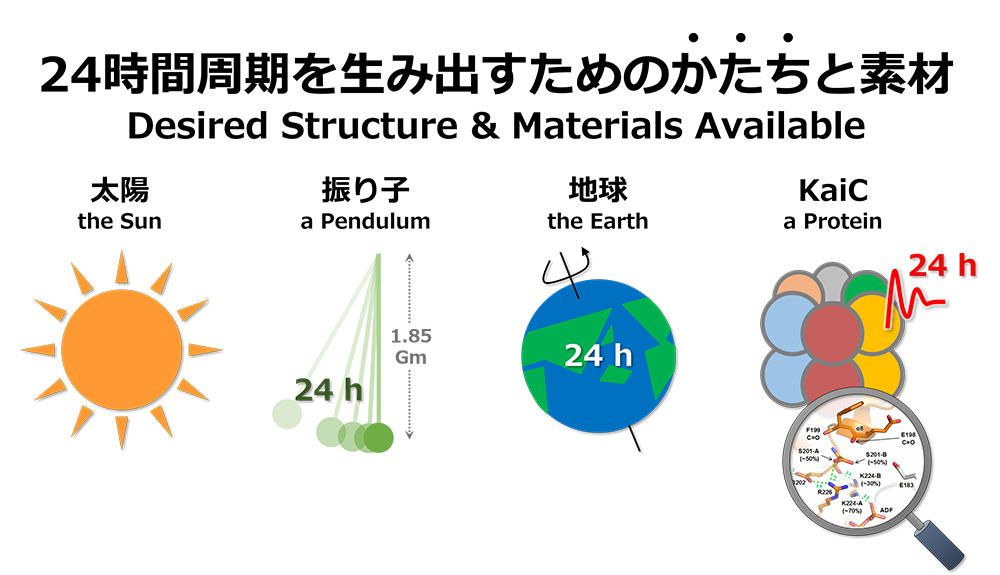
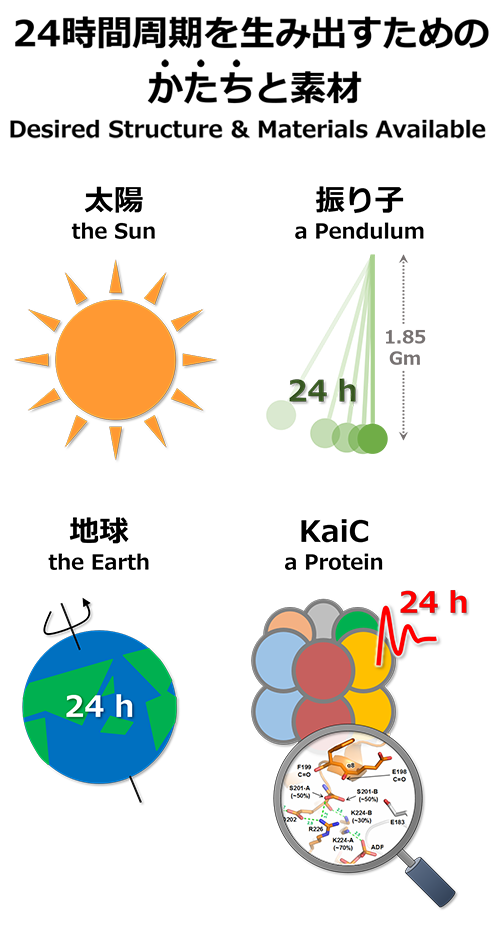
シアノバクテリアのin vitro振動子は逆のケースに相当します。素材はタンパク質とATPで確定していますが、24時間周期を実現しているかたちが不明です。タンパク質分子の運動は概ね10-12~101秒の時間領域に分布しており、24時間(104.94秒)に比べると非常に速いものです。KaiA、KaiB、KaiC単体やそれらの複合体の構造は解明されていますが、24時間という意味のある遅さを説明するかたちとは一体どのようなものなのでしょうか。
With the huge pendulum, the structure is known but the materials are unavailable; the inverse is true with the in vitro oscillator of cyanobacteria. Its materials are known to be proteins and ATP, but the structure that achieves the 24-hour cycle is unknown. The movements of protein molecules largely range from 10-12 to 10-seconds, which is much shorter than 24 hours (104.94 seconds). The structures of KaiA, KaiB, and KaiC, as well as those of their complexes, have been elucidated, but what is the structure that explains the relatively slow oscillation period of 24 hours?
KaiCはin vitro振動子の中核に位置付けられるタンパク質であり、そのATPase活性は周期長を決定する重要な因子の一つです(→ 概日リズムと階層性を参照)。ATPを加水分解する速度(12 ATP/日=0.5 h-1)が他の酵素よりも著しく遅いのが特徴で、概日時計として意義のある遅さを生み出す要因となっています。私たちがKaiCの構造を詳しく調べたところ、ATPase活性を抑制するための特別なかたちが発見されました(Abe et al. Science, 2015)。この遅い化学反応は、KaiCの自己リン酸化/脱リン酸化にも影響を及ぼすと考えられていますが、ATPase活性とリン酸化サイクルを関連付けるかたちは未だ明らかになっていません。
KaiC is the protein located at the core of the in vitro oscillator, with ATPase activity playing a critical role in determining the cycle length (see Circadian Rhythm and Hierarchy). The rate of ATP hydrolysis (12 ATP/day = 0.5 h-1) is markedly lower than that of other enzymes, which results in the slow chemical reaction needed for a circadian clock. In our detailed study of KaiC, we discovered this special mechanism for controlling ATPase activity (Abe et al. Science, 2015). This retarded chemical reaction is also thought to affect the autophosphorylation and dephosphorylation of KaiC, but the structure that associates ATPase activity and phosphorylation cycle is yet to be identified.
一方で、周期の温度補償性を実現するかたちについても研究が必要です。時計の周期を一定に保つという生理学的要求を満たすべく、KaiCのATPase活性には遅さに加えて温度補償性が付与されています。一般的な生化学反応は10度の温度上昇に伴って2~3倍加速され、とりわけ遅い化学反応は大きな活性化エネルギーを有するため更に加速される傾向があります。これらを考慮すると、遅さと温度補償性という一見排他的な特徴を両立させているKaiCの非凡さが際立ちます。このような観点でかたちと素材に整合性が認められる身近な例の一つが地球の自転運動です。体内時計システムにも遅さと温度補償性の両立を図るための仕組みが秘められているはずですが、素材を異にする場合、一体それはどのようなかたちなのでしょうか?
In the meantime, the structure that achieves the temperature compensation of the cycle also needs to be studied. To meet the physiological requirements needed to maintain a certain clock cycle, the ATPase activity of KaiC is vested with temperature compensation in addition to slowness. Biochemical reactions generally double or triple in speed when the temperature rises by 10 degrees; slow chemical reactions, which require a large amount of activation energy, tend to be especially accelerated. In view of these trends, it is remarkable that KaiC is characterized by both a slow chemical reaction and temperature compensation, as the two are apparently incompatible. Viewed in this light, Earth’s rotation is an immediate example of compatibility between structure and materials. The mechanism underlying the compatibility of a slow chemical reaction and temperature compensation must also be hidden in endogenous biological clock systems; if so, what structures do they possess when the materials are different?
Mystery #3: Evolutionary Diversity
KaiCはin vitro振動子の中核に位置付けられるタンパク質であり、そのATPase活性は周期長を決定する重要な因子の一つです。KaiCの機能(→ 概日リズムと階層性を参照)やかたち(→ かたちを参照)を詳しく調べたところ、24時間リズムの根源を想起させる現象を発見しました(Abe et al. Science, 2015)。KaiAとKaiBが共存すると、KaiCのATPase活性は24時間周期で発振します。KaiC単独では安定したリズムを刻むことができませんが、時間の経過とともに振幅を減じつつ活性を上下させる様子が観察されました。私たちはこの緩和過程に減衰振動のような信号成分が含まれることを見出し、そこに24時間周期に相当する周波数ωがエンコードされている可能性を提案しています。
KaiC is the protein located at the core of the in vitro oscillator, with ATPase activity playing a critical role in determining the cycle length. Our detailed study of the functions (see Circadian Rhythm and Hierarchy) and structures (see Structure) of KaiC has led to the discovery of a phenomenon that traces back to the origin of circadian rhythms (Abe et al. Science, 2015). When combined with KaiA and KaiB, KaiC has ATPase activity that oscillates on a 24-hour cycle. KaiC is not capable of maintaining a stable rhythm on its own, but its activity was observed to fluctuate with reduced amplitude over time. We have identified a signal component in this relaxation process that is similar to damped oscillation, and propose that it encodes the specific frequency, equivalent to a 24-hour cycle.
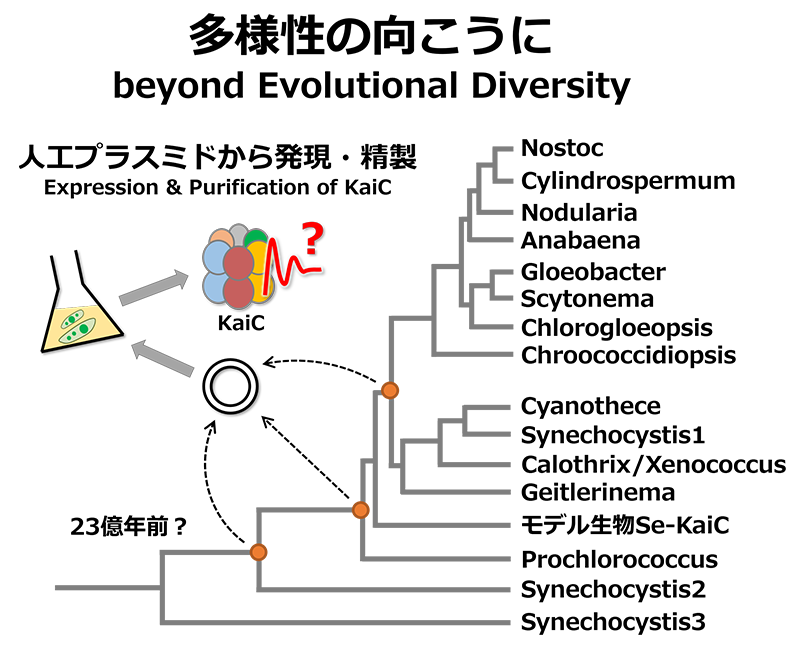
この提案について更なる議論や検証が待たれる一方、新たな研究展開が期待されています。シアノバクテリアのなかにはKaiAやKaiBの遺伝子が一部欠損している株が見受けられますが、KaiCが固有の周波数ωを保持しているとすれば、その理由にもある程度納得がいきます。このような考え方が的を射たものだとすると、他種・祖先型シアノバクテリアのKaiCおよびそのホモログはどのような固有周波数ωを持ち合わせているのでしょう?シアノバクテリアの生育環境は様々で、一言にKaiCといってもその配列空間はとてつもなく広いものです。KaiC―それは24時間周期のリズムを奏でる不思議なタンパク質分子。耳を澄ませば、多様性の向こうから「太古の地球のリズム」が聴こえてくるかもしれません。
As this proposal is further discussed and verified, development of new studies is expected. Some KaiA and KaiB genes are missing in several strains of cyanobacteria. This is understandable to some extent if KaiC possesses the specific frequency. Given our current understanding of this phenomenon, what specific frequencies are possessed by KaiCs and their homologues in other species and ancestral cyanobacteria? The habitats of cyanobacteria are diverse, so the space of their sequence is immense. KaiC is a mysterious protein that produces circadian rhythms. If you strain your ears, the rhythms of the ancient Earth may be heard from beyond evolutionary diversity.