
iMSaxs
iMSaxsは分子科学研究所が保有するX線溶液散乱装置の略称です。サブナノ~サブミクロンにわたる広い空間スケールを扱う本装置は、多階層からなる分子システム(生体高分子やソフトマター)の研究に貢献します。iMSaxsの利用に関するご相談や共同研究の申し込みについては、大学、研究機関、企業を問わずナノテクノロジープラットフォームが窓口となります。共同研究にとどまらず、X線溶液散乱実験に関心のある研究者・学生への指導、実験計画段階での相談、放射光ビームラインへの橋渡し、課題申請書の作成、などについて可能な限り支援をしています。
iMSaxs stands for integrated measurement system for small-angle x-ray scattering. This apparatus covers a wide range of spatial information from sub-nanometer up to sub-micrometer, accelerating your researches especially on molecular systems functioning over multiple layers of spatiotemporal hierarchies. Please contact the manager for any inquiries and/or application of the joint research using iMSaxs.
X線溶液散乱は、サブナノ~ミクロンに及ぶ構造情報が取得できる計測手法です。生体高分子やソフトマターのように階層性を帯びた分子システムの研究に役立ちます。球状タンパク質の場合、溶液中における分子の形や大きさを検証・推定することができます。
「生体高分子のX線溶液散乱について勉強してみたい」、
「どのように実験を計画すればよいのかわからない」、
「手持ちのタンパク質試料を使って実験してみたい」・・・、
等のご要望に添えるよう、秋山グループ@分子科学研究所では、毎回、ごく少数の研究グループを受け入れ対象とし、X線溶液散乱についての解説や、持ち込み試料等を用いた実技指導を行っています。
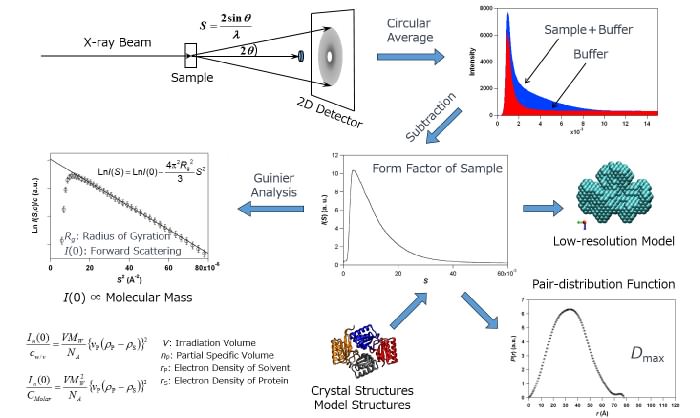
試料を光軸上に設置してX線を照射し、散乱されたX線の強度や角度分布を2次元検出器で記録します。均一なタンパク質溶液試料の場合、結晶性(配向性)試料とは違って散乱像は等方的になります。したがって、散乱原点を中心に円環平均すると散乱角度(Q)に依存した散乱X線強度I(Q)が得られます。タンパク質溶液からの散乱強度、溶媒のみからの散乱強度、これらを個別に記録して差分を取ると、溶質(タンパク質分子)の散乱曲線が得られます。この散乱曲線には構造情報が含まれており、ギニエ解析による回転半径や原点散乱強度の評価、間接フーリエ変換による動径分布距離解析、低分解能像(分子形状)の推定、既知の結晶構造との比較、などを通してタンパク質分子の大きさや形状を見積もります。
A sample is irradiated with x-ray, and the intensity of scattered x-ray is recorded on the 2D detector. Because a solution sample containing a monodispersed protein gives isotropic scattering patterns in contrast to crystalline- and oriented-samples, circular averaging round the origin results in the x-ray scattering intensity, I(Q), as a function of the scattering angular momentum (roughly speaking, angle), Q. In ordinary experiments, the scattering intensities of the protein solution and of its matching buffer without the proteins are recorded separately, and the latter is subtracted from the former to extract the scattering curve of the solute, i.e. hydrated protein molecules. The SAXS curve can be analyzed from many perspectives to evaluate the size and shape; Guinier analysis to obtain radius of gyration (Rg) and forward scattering intensity, pair-distribution function estimated by indirect Fourier transformation, low-resolution shape reconstruction, and comparisons with the crystal and/or model structures in reciprocal space.
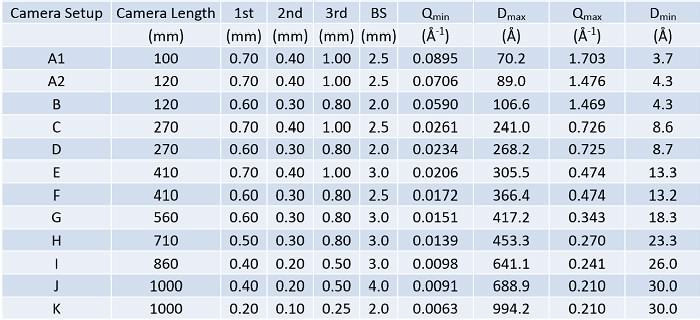
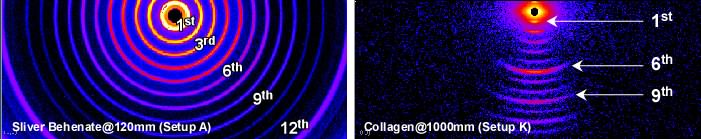
検出器はDECTRIS社のPILATUS 200Kを採用しています。検出器を平行移動させることで、モジュール間の継ぎ目のない散乱・回折パターンを記録することもできます。各スリットのピンホール径、ビームストッパー径、試料と検出器の距離などを変化させて、試料に最適な小角カメラを選びます。上表のように、現状ではA~Kで区別される11段階の小角カメラで運用しています。それ以外の小角カメラ設定については管理者と要相談です。状況にもよりますが、カメラ長変更+光学調整には約1時間を要します。
The PILATUS 200K@DECTRIS is a hybrid pixel array detector of 1 × 2 PILATUS modules. Users are requested to select an optimized camera setup from 11 different ones (A ~ K), each differs in the pinhole diameter of slits, the beam-stopper diameter, and the sample-detector distance. It takes roughly one hour to move one camera setup to the other.
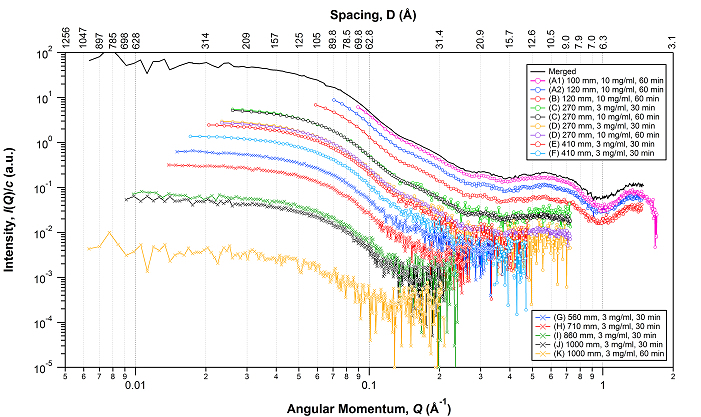
標準試料として用いられる牛血清アルブミン(BSA)の散乱パターンをA~Kの小角カメラで記録しました(上図)。3mg/mlの試料濃度で30min積算を基本とし、広角測定(A, B)と極小角測定(K)では10 mg/mlで60 minの積算としている。図中の散乱曲線は試料濃度と露光時間に対して規格化されていますが、ビーム強度に対しては規格化されていません。小角カメラ設定がAからKとなるにつれ、測定可能領域は広角(高分解能)側から小角(低分解能)側へとシフトしていき、同時に入射ビーム強度が弱くなるために信号強度が弱くなっていきます。
Bovine serum albumin (BSA) is often used as a standard sample. In the above figure, the SAXS curves of 3 (or 10) mg/ml BSA were taken with a 30 (or 60) min exposure time at different camera setups (A~K), and were normalized by both the sample concentration and exposure time, but not by the intensity of the incident x-ray beam. As the camera setup goes from A to K, the range covered by the detector shifts in the lower angle and the intensities of the incident/signal x-ray become lower.

溶液試料には専用セルとセルホルダが準備されています。標準セルの容量は26マイクロリットルです。試料体積のより小さいセルでも測定可能ですが、その場合は管理者と事前に相談のこと。試料温度は4~100℃の範囲で制御可能です。個体試料(フィルム、ファイバーなど)についても専用の試料ホルダを用いて測定できます(温調はなし)。
The volume of a standard cuvette dedicated to aqueous samples is 26 micro litter. The cuvette is reversibly mounted and dismounted onto the temperature-controlling cuvette holder (from 4 to 100 deg.C.).

iMSaxsの周囲には生化学実験を行うための機器類が整備されており、タンパク質をはじめとする生体高分子試料の調製や評価ができます。主な機器としては、微量分光光度計(NanoPhotometer P330, Implen)、電子天秤(CP3202S, CP224S, Sartorius)、pH計(LAQUA F-73, HORIBA)、高速液体クロマトグラフィー(AKTA-FPLC, GE)、動的光散乱(DynaPro Titan, Wyatt)、卓上クリーンベンチ(Clean Booth BB-100, AS ONE)、超音波洗浄機(1510J-MT, BRANSON)、微量透析システム(Bio-Tech, COSMO BIO)などがあります。
iMSaxs is installed together with apparatus for preparations and evaluations of user’s samples; spectrophotometer (NanoPhotometer P330, Implen), electronic balances (CP3202S, CP224S, Sartorius), pH meter (LAQUA F-73, HORIBA), HPLC (AKTA-FPLC, GE), dynamic light scattering (DynaPro Titan, Wyatt), desktop clean bench (Clean Booth BB-100, AS ONE), supersonic washers (1510J-MT, BRANSON), and oscillatory microdialysis system (Bio-Tech, COSMO BIO).
 |
SasDR (ver 1.3) ≫ Download (for registered users) ≫ Registration (for new users) |
小角散乱のイメージデータを一次元化するソフトウェア
A software to reduce the 2D image data into 1D scattering curve.
 |
SasAvg (ver 1.0) ≫ Download (for registered users) ≫ Registration (for new users) |
SasDRを用いて一次元化した小角散乱データを平均化するためのソフトウェア
A software to calculate an average of multiple 1D scattering curves.
 |
SasExtrap (ver 1.0) ≫ Download (for registered users) ≫ Registration (for new users) |
散乱データセットをゼロ濃度外挿するためのソフトウェア
A software to estimate a scattering curve extrapolated to infinite dilution
 |
NanoVCtrl (ver 1.0) ≫ Download (for registered users) ≫ Registration (for new users) |
リガク社製NanoViewerに測定シークエンスを伝達し、計測条件をxmlファイルとして出力するためのソフトウェア
A software to send information of measurement sequence to NanoViewer@RIGAKU and to export measurement conditions as xml files for SasDR.
 |
dTREK2TIFF (ver 1.0) ≫ Download (for registered users) ≫ Registration (for new users) |
d*TREKファイルをPilatus200KのTIFFファイルに変換するためのソフトウェア
A software to convert d*TREK@RIGAKU into TIFF@Pilatus200K.
Anzai I, Tokuda E, Handa S, Misawa H, Akiyama S, Furukawa Y*
Oxidative misfolding of Cu/Zn-superoxide dismutase triggered by non-canonical intramolecular disulfide formation
Free Radical Biology and Medicine 147, 187-199; doi.org/10.1016/j.freeradbiomed.2019.12.017 (2020)
Okumura M*, Noi K, Kanemura S, Kinoshita M, Saio T, Inoue Y, Hikima T, Akiyama S, Ogura T*, Inaba K*
Dynamic assembly of protein disulfide isomerase in catalysis of oxidative folding
Nature Chemical Biology 15, 499–509; doi: 10.1038/s41589-019-0268-8 (2019)
Nuemket N, Yasui N, Kusakabe Y, Nomura Y, Atsumi N, Akiyama S, Nango E, Kato Y, Kaneko M K, Takagi J, Hosotani M, Yamashita A*
Structural basis for perception of diverse chemical substances by T1r taste receptors
Nature Communications 8, 15530 (2017)
Anzai I, Tokuda E, Mukaiyama A, Akiyama S, Endo F, Yamanaka K, Misawa H, Furukawa Y*
A misfolded dimer of Cu/Zn-superoxide dismutase leading to pathological oligomerization in amyotrophic lateral sclerosis
Protein Science doi: 10.1002/pro.3094 (2016)
Kanemura S, Okumura M, Yutani K, Ramming T, Hikima T, Appenzeller-Herzog C, Akiyama S, Inaba K*
Human ER oxidoreductin-1α (Ero1α) undergoes dual regulation through complementary redox interactions with Protein Disulfide Isomerase (PDI)
Journal of Biological Chemistry 291, 23952-23964 (2016)
Nango E, Akiyama S, Maki-Yonekura S, Ashikawa Y, Kusakabe Y, Krayukhina E, Maruno T, Uchiyama S, Nuemket N, Yonekura K, Shimizu M, Atsumi N, Yasui N, Hikima T, Yamamoto M, Kobayash Y, Yamashita A*
Taste Substance Binding Elicits Conformational Change of Taste Receptor T1r Heterodimer Extracellular Domains
Scientific Reports 6, 25745; doi: 10.1038/srep25745 (2016)
Furukawa Y*, Anzai I, Akiyama S, Imai M, Cruz FJC, Saio T, Nagasawa K, Nomura T, and Ishimori K
Conformational Disorder of the Most Immature Cu,Zn-Superoxide Dismutase Leading to Amyotrophic Lateral Sclerosis
Journal of Biological Chemistry 291, 4144-4155 (2016)
Mukaiyama A, Osako M, Hikima T, Kondo T, and Akiyama S*
A protocol for preparing nucleotide-free KaiC monomer
BIOPHYSICS 11, 79-84 (2015)
Kojima R, Okumura M, Masui S, Kanemura S, Inoue M, Saiki M, Yamaguchi H, Hikima T, Suzuki M, Akiyama S and Inaba K*
Radically Different Thioredoxin Domain Arrangement of ERp46, an Efficient Disulfide Bond Introducer of the Mammalian PDI Family
Structure 22, 431-443 (2014)