サイト内検索
分子研について
研究情報
共同利用案内
- 共同研究・施設利用案内
- 申請概要
- 共同研究受入研究室・利用装置一覧
- WEB申請
大学院
- 大学院教育
- 大学院案内
- 受験生向け情報
- 他大学の学生の受け入れ
- 在校生向け情報
[はじめに]
私たちが研究対象としている糖鎖は、核酸・タンパク質とならぶ第3の生命鎖ともよばれる。自然界に存在するタンパク質全種類の実に半数以上は糖鎖による修飾を受けた糖タンパク質として存在していると言われている。糖鎖はタンパク質の溶解性や安定性といった物理化学的性質を規定しているばかりでなく、細胞間コミュニケーションやウィルス感染にあずかる生体分子認識を媒介している。このような生物学的重要性にもかかわらず糖鎖の分子科学的研究はタンパク質や核酸に比べて著しく立ち遅れてきた。それは糖鎖の複雑性に起因している(図1)。例えば、糖鎖の構造はゲノムに直接コードされておらず、他の生命鎖にはみられない分岐構造と著しい不均一性を示している。そのために、糖鎖の合成や配列決定は容易ではない。加えて糖鎖は運動性が高いために結晶化は困難である。このためこれまでの構造生物学研究は往々にして糖鎖の存在を無視して行われてきた。私たちはこうした様々な困難を克服して糖鎖が担う生命情報を解読する体系的な研究戦略を構築(図2)してきた。
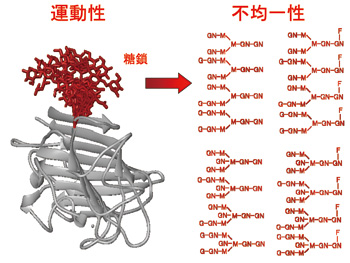
図1 糖タンパク質の構造解析の困難さを示す概念図。タンパク質を修飾する糖鎖は構造が不均一であるうえに内部運動の自由度に富んでいる。
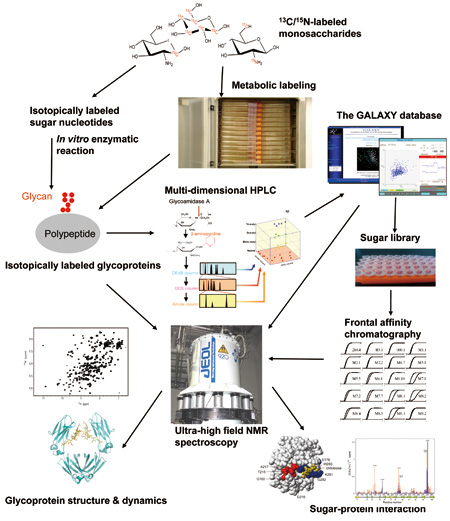
図2 糖タンパク質の構造解析を行うための体系的戦略。
[糖鎖を研究するための基盤技術の構築]
糖鎖は残基間の連結様式が多様であるために膨大な数の異性体が存在し得る。そのために配列決定すら困難である。幸いなことにこの問題は名古屋市立大学の高橋禮子博士(現・名誉教授)が考案した3次元HPLC法によって解決される。この方法は、蛍光標識した糖鎖混合物を3種類のHPLCカラムによって分離するとともにその溶出位置に基づいて構造を同定する方法である[1]。私たちはこの方法に基づいて構築した3次元HPLCデータベースGALAXYを構築し、ウェブアプリケーションとして公開している(http://www.glycoanalysis.info/)。これを用いることにより、構造機能解析を行うための糖鎖標準品のライブラリーを整えることもできている。
NMRは結晶化が困難な糖タンパク質の構造解析においても潜在的な有用性を有している。しかしながら、糖鎖はタンパク質などに比べて官能基の多様性に乏しいためにスペクトル中でのピークの重なり合いが激しい。こうした場合に威力を発揮するのが超高磁場NMR装置である[2]。ただし、糖鎖は水溶液中でNMRシグナルを与える1Hの数が少ないため、核オーバーハウザー効果に基づく原子間距離情報を収集することが困難である。山口拓実助教らはこの問題を解決するために化学修飾によって糖鎖の末端にランタニドイオンを配位することが可能なタグを設計・導入し、常磁性効果を利用した糖鎖のコンフォメーション解析に取り組んでいる。
NMRを利用した生体高分子の構造解析の可能性は、試料を13Cなどの安定同位体で標識することにより格段に広がる。糖鎖を対象にした安定同位体標識はこれまで未開拓な状況にあったが、私たちは試験管内における酵素反応や真核細胞の代謝経路を利用してこれを実現するための方法論の開発にも力を注いできた[3]。図3 は全ての炭素と窒素を13Cと15Nで標識した免疫グロブリンのFc領域の920 MHz NMRスペクトルを示す。こうした試料を用いることにより、糖タンパク質の糖鎖とポリペプチド鎖に由来する信号を系統的に観測することが可能となり、糖鎖構造 の改変に伴う分子の3 次元構造の変化を原子レベルの分解能で追跡することができるようになった。
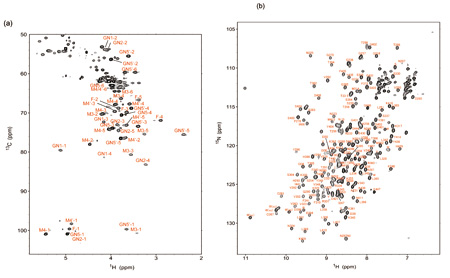
図3 13Cと15Nで標識した免疫グロブリンのFc領域(52kDaの糖タンパク質)の(a)糖鎖と(b)ポリペプチド鎖のHSQCスペクトル[3]。
[タンパク質による糖鎖認識の構造基盤]
糖鎖の機能は多くの場合、タンパク質との相互作用を通じて発揮視されている。糖鎖を認識するタンパク質は一般にレクチンとよばれている。古典的なレクチンは主に細胞外の環境で機能しているが、最近は細胞の中にも様々なレクチンが存在することが明らかとなってきた。神谷由紀子特任助教は、糖鎖ライブラリーを駆使してこれら一連の細胞内レクチンの糖鎖認識の特異性を解き明かし、その機能発現メカニズムの理解の進展に貢献してきた[4,5]。その成果をまとめたのが図4である。 細胞の中で新たに生合成されたポリペプチド鎖には3 本の枝をもった糖鎖が付加されるが、特異的な酵素反応によって糖残基が端から順次切除されていく。こうした糖鎖のプロセシングの過程で現れる中間体に対して細胞内レクチンが順次相互作用し、糖鎖を担うタンパク質を異なる運命(フォールディング、輸送、分解)へと導いていくのである。
このような巧妙な仕組みは、レクチンが標的となる糖タンパク質と細胞内環境に応じて調節的に相互作用することに基づいている。例えば、積荷受容体として機能するレクチンは細胞内pHを感知する仕組みを糖鎖認識部位に獲得していることを明らかにしてきた(図5)。さらに、細胞内レクチンがパート
ナータンパク質と連携して血液凝固因子の細胞内輸送を司るメカニズムにも迫りつつある[6]。
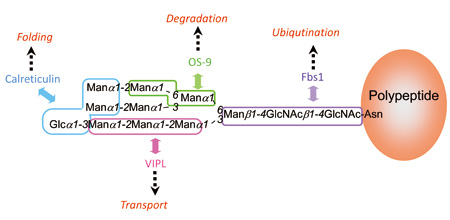
図4 糖タンパク質の細胞内運命を決定するレクチンによる糖鎖上の認識部位。
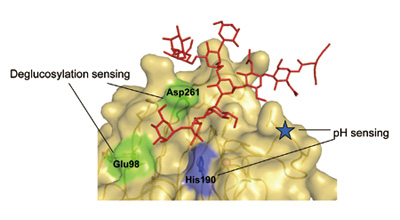
図5 積荷受容体として機能する細胞内レクチンVIP36 が糖鎖結合部位に獲得した分子機能[4]。
[糖鎖クラスターを舞台とする分子間相互作用]
糖鎖のなかには脂質分子を修飾して細胞表層でクラスターを形成するものもある。例えば、アルツハイマー病の発症に関与するアミロイドβ(Aβ)の重合は、神経細胞表層に存在する糖脂質GM1ガングリオシドのクラスターとの相互作用を契機として促進される。したがって、本疾患の発症メカニの相互作用の実体を明らかにすることが重要である。しかしながら、ペプチドと糖鎖と脂質からなる複合体は不均一かつ不安定であるため、通常の構造生物学によるアプローチは困難であった。私たちのグループの矢木真穂博士は、GM1の小型クラスターの構築と超高磁場NMR計測によりこうした問題を克服し、AβがGM1クラスターの親水領域と疎水領域のインターフェースにおいて一定のトポロジーを呈して捕捉されていることを明らかにした(図6)[7, 8]。この結果は、GM1クラスターがAβ の構造変化と分子間相互作用を誘起するための限定された空間を提供していることを初めて示すものである。こうして空間配置を規定されることにより、Aβ 分子間の特異的な相互作用が促され、重合体形成に至るものと考察される。
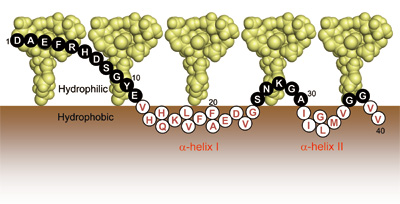
図6 NMR解析の結果に基づくAβとGM1 クラスターの相互作用の模式図[7]。
[まとめと今後の展開]
以上述べたように、多次元HPLC法、糖鎖ライブラリー、糖鎖の安定同位体標識、超高磁場NMR解析など、糖鎖の体系的な構造解析を行うための基盤技術を整え、これを応用した研究を展開してきた。糖鎖分子科学の今後の重要課題は、水溶液中における糖鎖のコンフォメーションの揺らぎや水和の問題を積極的に取り扱うことである。糖鎖- タンパク質相互作用さらには糖鎖-糖鎖相互作用のエナジェティクスを定量的に議論するためには、遊離状態と結合状態のそれぞれについて理解を深めることが不可欠である。また、糖鎖による分子認識は本質的に弱い相互作用の集積を通じ実現されていることから、精密な構造解析を行うためには適切にクラスター化した糖鎖を設計してNMR計測を行うことが必要である。このような基盤の上に展開される超高磁場NMR分光学と計算科学との連携が、糖鎖の分子科学の今後の進展において重要となってくるであろう。
■参考文献
K. Kato and N. Takahashi, Experimental Glycoscience: Glycobiology, Springer, pp. 413-416 (2008)
2) K. Kato, H. Sasakawa, Y. Kamiya, M. Utsumi, M. Nakano, N. Takahashi, and Y. Yamaguchi, Biochim. Biophys. Acta -General Subjects 1780, 619-625 (2008)
3) K. Kato, Y. Yamaguchi, and Y. Arata, Progress in Nuclear Magnetic Resonance Spectroscopy 56, 346-359 (2010)
4) Y. Kamiya, D. Kamiya, R. Urade, T. Suzuki, and K. Kato, Glycobiology Research Trends NOVA Science Publishers, pp. 27-40 (2009)
5) N. Hosokawa, K. Kato, and Y. Kamiya, Methods in Enzymology 480, 181-197 (2010)
6) M. Nishio, Y. Kamiya, T. Mizushima, S. Wakatsuki, H. Sasakawa, K. Yamamoto, S. Uchiyama, M. Noda, A.R. McKay, K. Fukui, H.-P. Hauri, and K. Kato, Proc. Natl. Acad. Sci. USA 107, 4034-4039 (2010)
7) M. Utsumi, Y. Yamaguchi, H. Sasakawa, N. Yamamoto, K. Yanagisawa, and K. Kato, Glycoconjugate J. 26, 999-1006 (2009)
8) M. Yagi-Utsumi, T. Kameda, Y. Yamaguchi, and K. Kato, FEBS Lett. 584, 831-836 (2010)